Portrait de Guy Lenaers : directeur de recherche au CNRS à Angers
Dans le cadre de son action de financement de la recherche médicale, l’UNADEV s’est associée à l’Alliance pour les sciences de la Vie et de la Santé (AVIESAN) pour mettre en œuvre une procédure d’attribution de subventions. Chaque année, depuis 2014, ce sont donc une dizaine de programmes de recherche autour de la vision qui sont ainsi récompensés. Derrière ce travail scientifique, se cachent des hommes et des femmes passionnés qui consacrent leur vie aux mieux-être des déficients visuels. Dans le cadre de cette nouvelle série d’articles, nous avons décidé de les mettre en lumière. C’est donc par Guy Lenaers, Directeur de recherche au CNRS à Angers pour son projet intitulé « Des gènes aux thérapies de l’atrophie optique dominante », que nous débutons. Comment un chercheur décide-t-il un jour de travailler sur un sujet comme celui-ci ? Quelles sont les conséquences et les applications concrètes qui découlent de ces recherches ? C’est ce que nous avons essayé de comprendre à travers notre entretien.
Comment devient-on « Directeur de recherches spécialisé dans les maladies mitochondriales » ?
Cela ne se fait pas du jour au lendemain. En tant que chercheur, ma thèse portait sur des organismes unicellulaires marins à l’Observatoire Océanographique de Banyuls sur Mer. Je suis parti ensuite deux ans en Californie pour étudier la génétique de la levure. Recruté au CNRS en 1992, j’ai poursuivi mes recherches sur les ovocytes d’étoile de mer, avant de rejoindre l’Université de Toulouse. C’est là, que j’ai établi un lien entre la division cellulaire et les mitochondries, en identifiant le gène OPA1, et sa position chromosomique au locus (Un locus peut être un endroit du chromosome où se situe un gène, ndlr) de l’Atrophie Optique Dominante. J’ai alors contacté Christian Hamel, Directeur de l’Institut de Neurosciences de Montpellier et ensemble nous avons établi le lien entre les mutations de ce gène et la cécité héréditaire liée à une altération du nerf optique. Lui c’était « l’ophtalmo », moi le chercheur… Christian Hamel nous a quittés il y a quelques jours, je tenais à lui rendre un hommage ému, pour tout ce qu’il m’a apporté professionnellement et amicalement.

Guy Lenaers, lauréat appel à projets UNADEV / AVIESAN 2017 « Des gènes aux thérapies de l’atrophie optique dominante »
En 2003, j’ai pris la direction d’une thématique de recherche à Montpellier sur les Neuropathies Optiques Héréditaires dans l’équipe de Christian. En 2015, je me suis installé à Angers pour créer le Pôle de recherche et d’enseignement en médecine mitochondriale (PREMMi), première structure en France dédiée aux maladies mitochondriales héréditaires et communes, dont l’Atrophie Optique Dominante.
Pouvez-vous en quelques mots nous dire ce qu’est l’Atrophie Optique Dominante ?
C’est une neuropathie optique caractérisée par une dégénérescence des nerfs optiques entraînant une perte visuelle progressive. Elle débute généralement durant les dix premières années de vie. La sévérité de la maladie est variable, pouvant aller d’une simple altération de la vue à la cécité totale. On constate une acuité visuelle moyenne (entre 2/10 et 6/10), une perte de la vision centrale, et une altération de la vision des couleurs. Lors de l’examen ophtalmologique, la rétine est normale en revanche, la papille optique affiche une pâleur extrême, signe de l’absence de très nombreuses fibres optiques.
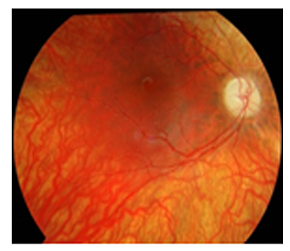
Fond d’œil d’un patient atteint d’atrophie optique dominante.
Donc, votre domaine de recherche porte sur les cécités liées à la dégénérescence des nerfs optiques ?
Il faut comprendre la vision comme étant un mécanisme qui va impliquer 3 éléments : l’œil, le nerf optique, qui est le nerf qui transporte l’information au cerveau, et le cortex visuel, qui lui, va interpréter et stocker l’information visuelle.
Il existe des maladies qui touchent l’œil, le nerf optique et le cerveau. Si l’on imagine l’œil dans son ensemble comme un appareil photo, la partie antérieure, c’est l’objectif et ses pathologies sont liées à de mauvaises « mises au point » de la vision. La partie postérieure de l’œil est comme le boitier de l’appareil, c’est la partie photosensible. Cela concerne ici les maladies du cristallin, la cataracte, les rétinites, etc.
Nous, nous travaillons sur les maladies du nerf optique. Ce nerf est une sorte de câble qui transfère l’information visuelle de la rétine au cerveau. Il est composé de 1.2 millions de « fibres optiques » qui débitent 15 informations par secondes. Soit pour chaque œil, 20 Mbits d’informations transférées par seconde, jours et nuits.
Les neuropathies optiques héréditaires, dont l’Atrophie Optique Dominante, sont des causes importantes de cécité dans la société occidentale, elle concerne de 3 000 à 4 000 patients en France.
Notre recherche s’oriente donc autour de trois axes majeurs : identifier les gènes et les mécanismes mitochondriaux affectés, comprendre pourquoi l’atteinte mitochondriale affecte spécifiquement le nerf optique, et développer des solutions thérapeutiques.
Nos travaux débutent par une approche génétique pour identifier les gènes et mutations causales des neuropathies optiques héréditaires, qui sont essentiellement dominantes. On parle de « Dominante », car la plupart du temps un des deux parents est atteint, et que le patient aura une chance sur deux de transmettre sa maladie à chacun de ses enfants. Ensuite, nous étudions les mécanismes pathologiques de ces maladies à partir d’échantillons prélevés chez les patients, ainsi que chez des souris reproduisant les mutations génétiques observées chez l’humain. Ces deux modèles biologiques sont essentiels pour rechercher de nouveaux traitements visant à ralentir, voire à prévenir l’évolution de la maladie.
Être lauréat de l’appel à projets UNADEV / AVIESAN 2017, cela signifie quoi pour vous ?
A titre personnel, l’obtention du soutien de l’UNADEV est une grande satisfaction, et ce pour de multiples raisons : je pense avant tout aux patients qui attendent un diagnostic moléculaire, et un traitement qui pour l’instant n’existe pas, je pense ensuite aux jeunes chercheurs brillants et prometteurs de mon équipe que je pourrai maintenir dans cette thématique de recherche grâce à la subvention de l’UNADEV, et je pense enfin à l’importance de leur travaux pour pallier les limites actuelles de la médecine.
Les patients, leur diagnostic et les traitements sont au cœur de nos préoccupations quotidiennes, tout cela dans un contexte humain qui vise à former et insérer les jeunes dans le métier de la recherche scientifique et clinique.
Notre travail de recherche est une véritable course contre le temps. Avec l’argent des subventions, nous pouvons accélérer nos investigations, et nous contribuons à l’avancée des connaissances sur la maladie, résultats qui sont ensuite diffusés dans le monde entier sous la forme de publications et de rencontres et discussions dans les congrès scientifiques.
Et puis la recherche n’aurait pas tant progressé, s’il n’y avait eu des associations de patients comme l’UNADEV, car globalement les gens, la population, ne se sentent pas concernés par ces maladies rares.
L’argent fait avancer la recherche, la recherche fait avancer la médecine, quelles sont aujourd’hui, les applications concrètes de vos recherches ?
Nous offrons avant tout un diagnostic moléculaire aux patients. C’est notre priorité car aujourd’hui encore, un patient sur deux reste sans savoir quel est le gène incriminé dans sa maladie. Or, ils savent pertinemment que tant qu’il n’y a pas de diagnostic génétique, il n’y a pas de recherche sur leur maladie. Les patients pour lesquels on établit un diagnostic savent quel est le « coupable », c’est très important pour eux. Dans ce sens, à Angers, on analyse des milliers d’ADN venant du monde entier, avec des technologies de pointe en séquençage pour identifier la ou les mutations responsables.
Autre point important pour les patients, à Angers existe une Plateforme Régionale d’Information et d’Orientation sur les maladies Rares (PRIOR) permettant une prise en charge sociétale des patients et de leurs familles touchées par la maladie.

Matériel de recherche génétique
Par ailleurs, en parallèle à nos avancées scientifiques et médicales, il existe un Centre Régional « Basse vision » à Angers, qui prend en charge la rééducation des patients dans le but de maximiser leur autonomie au quotidien et de rétablir leur confiance dans leur vie avec leur nouvel handicap. Ensemble, avec le CRBV, le CHU et l’Université d’Angers, nous avons réalisé deux films de sensibilisation à la basse vision, visibles sur le site du PREMMi.
Pour conclure, je crois qu’il est important de communiquer sur nos avancées. Les patients doivent savoir que les choses progressent. Nous serons d’ailleurs présents le 12 octobre à Paris pour le Colloque UNADEV–AVIESAN /ITMO NNP « Les maladies de la vision : origines et traitements ». Nous pourrons expliquer où en est l’avancée de nos recherches, quels sont les travaux en cours et surtout quelles sont les futures solutions thérapeutiques testées actuellement.





